TRANSPORTES TRANSMEMBRANARES
A célula, como sistema aberto que é, necessita, para o seu normal funcionamento e reprodução, de captar matéria, do meio exterior. A matéria captada destina-se não só a criar novas estruturas celulares, como também ao fornecimento de energia. Sob a forma de pequenas moléculas ou de iões, de macromoléculas ou mesmo de partículas complexas, a matéria transita do exterior para o interior, transpondo a membrana, barreira física selectiva, recorrendo a mecanismos de complexidade variada e com encargos energéticos diferenciados para a economia celular. Se há moléculas, como a água, o anidrido carbónico ou o oxigénio, que transitam com extrema facilidade através da membrana plasmática, por simples difusão, outras há que, pela sua dimensão ou lipofobia, implicam a instalação, na membrana, de mecanismos específicos. No caso de partículas complexas ou mesmo de macromoléculas, a captação tira partido da plasticidade da membrana, que se deforma especialmente para abraçar os corpos a captar e os interiorizar, submetendo-os de seguida, em geral, a um processo interno de digestão que faz apelo à intervenção dos lisossomas.
Embora o enfoque seja colocado nos transportes que se operam através da membrana plasmática, isto é, entre a célula e o meio circundante, importa ter presente que idênticos mecanismos ocorrem nas membranas citoplasmáticas, entre a fase interna e a fase externa (ver Conceito Trifásico da Célula Eucariótica).
Difusão
O mecanismo físico mais simples de tráfego molecular através da membrana, é a difusão. As moléculas, quer se encontrem de um lado, quer do outro da membrana, são objecto de intensa agitação (função da temperatura); consequentemente, são portadoras de energia cinética. Em caso de choque com a membrana, poderão passar através dos fosfolípidos, rompendo, por ventura, instantânea e pontualmente algumas das ligações lábeis que os unem .
A maior ou menor facilidade com que as moléculas transitam através da membrana traduz-se pelo coeficiente de permeabilidade, determinado em relação a uma dupla camada fosfolipídica artificial e expresso em mm.s-1 .

O coeficiente de permeabilidade é, compreensivamente, função essencialmente de três factores:
1. a dimensão da molécula (existindo uma correspondência, ainda que grosseira, entre dimensão e peso molecular, é habitualmente a este último que nos referimos) ;
2. o seu estado de ionização;
3. a afinidade para com os lípidos. Esta traduz-se pelo seu coeficiente de partição, o qual se calcula pela razão entre a solubilidade num óleo determinado e a solubilidade na água.
Permeabilidade diferenciada de diferentes categorias de moléculas
Finalmente, tratando-se de iões, a permeabilidade reduz-se drasticamente, ao ponto de ser praticamente nula a probabilidade de difusão dos catiões e aniões habituais (Na+, K+, Ca2+, Mg2+, Cl-, etc.) através da camada de fosfolípidos. Assim, a maior ou menor permeabilidade que caracteriza uma determinada molécula será função destas suas características, sendo expectável, por exemplo, que uma molécula de maior peso molecular, mas francamente lipófila, apresente um coeficiente de permeabilidade superior a uma molécula de menor dimensão, mas lipófoba.
Assim sendo, deverão coexistir, na membrana, a par da simples difusão, outros mecanismos que proporcionem o abastecimento da célula em moléculas necessárias ao metabolismo mas que, pelas suas características físicas, apresentam uma permeabilidade fraca ou mesmo nula. Aos sistemas, mais ou menos complexos, através dos quais as moléculas franqueiam a barreira membranar, atribui-se a designação genérica de transportes. Uns, não consomem energia; são designados por transportes passivos, mesmo quando essa "passividade" encerra uma elevada complexidade . Outros, pelo contrário, consomem energia; são por isso designados por transportes activos.
Transportes passivos
Designam-se genericamente por transportes passivos, todos aqueles que não impliquem, por parte da célula, dispêndio de energia. Englobam-se nesta categoria, os transportes de electrólitos ou de não electrólitos que se efectuam, respectivamente, a favor do gradiente de potenciais electroquímicos ou de concentrações. Há todavia que distinguir duas situações distintas, decorrentes da natureza das moléculas e das suas permeabilidades: ou se trata de entidades que podem atravessar a membrana por simples difusão ou, pelo contrário, de moléculas que o não podem e, para as quais, a célula dispõe de mecanismos que facilitam o respectivo tráfego.
Transporte da água e dos gases
a) Água
A molécula da água possui um elevado coeficiente de permeabilidade (127 mm.s-1). A sua difusão através da membrana (assimilada, em termos teóricos, a uma membrana semi-permeável) designa-se por osmose. A osmose justifica a variação do volume das células quando estas entram em contacto com meios quer hipertónicos (de mais elevada concentração, relativamente a solutos), quer hipotónicos (de menor concentração).
Duas situações ilustram as consequências da osmose. A primeira é relativa aos glóbulos vermelhos (hemácias); a outra, tem a ver com o comportamento da célula vegetal em confronto com meios não isotónicos.
É sabido que a concentração em cloreto de sódio do nosso plasma sanguíneo é aproximadamente de 0,9%. As hemácias, em equilíbrio isotónico, assumem normalmente a forma de discos, relativamente côncavos no centro. Porém, quando confrontados com um plasma (ou uma solução salina) hipotónico, as hemácias incham e tendem para a esfericidade, em virtude da entrada de água por osmose. Caso a tenção interna venha a superar as forças de coesão que ligam os fosfolípidos membranares entre si, o que acontece quando a concentração do meio atinge cerca de 0,5%, a membrana rompe-se e a hemoglobina perde-se no meio exterior. Este fenómeno é designado por hemólise. Em situação inversa, as hemácias colocadas num meio hipertónico, tendem a perder a pouca água que possuem e mirrarem.
Hemólise
A: perfil habitual de um glóbulo vermelho;
B: Glóbulo vermelho “inchado” em consequência da hipotonicidade do meio;
C: Hemólise
Ao invés, a célula vegetal é vulnerável aos ambientes hipertónicos. A saída da água contida no seu vacúolo, provoca uma diminuição do volume celular e, consequentemente, o afastamento da membrana plasmática relativamente à parece celular. Este fenómeno designa-se comumente por plasmólise.
Plasmólise. A: Conformação habitual de uma célula vegetal; B: célula vegetal sujeita um meio hipertónico
As variações de volume que se referiram são consequência das diferenças de pressão osmótica entre as duas faces da membrana plasmática
Demonstra-se experimentalmente que a permeabilidade da membrana à água aumenta com a sua fluidez, induzida por um incremento do número de ligações não saturadas nas cadeias alifáticas dos fosfolípidos. Pela mesma razão, assiste-se a uma diminuição da permeabilidade com o aumento do teor em colesterol incorporado na membrana.
A grande diferença que se observa entre o coeficiente de permeabilidade da água medido na situação real de uma membrana plasmática e o respectivo coeficiente de difusão (53, derminado em condições ideais, leva a concluir que a passagem da água não se opera exclusivamente por difusão através da bicamada lipídica, mas que deverão existir poros ou canais por onde as moléculas de água possam transitar mais facilmente. Trabalhando com eritrócitos humanos (hemácias), foi possível deduzir teoricamente que os referidos canais deverão possuir diâmetros da ordem dos 700 pm.
Por sua vez, demonstra-se experimentalmente, que a disposição das proteínas intrínsecas pode também, em certas circunstâncias, favorecer o fluxo de água através da membrana. Tal facto foi posto em evidência na bexiga de determinados anfíbios
Disposição de proteínas intrínsecas na membrana das células epiteliais da bexiga de anfíbios. A: antes da administração da hormona antidiurética; B: depois da acção da hormona (comparação do esquema com imagens de microscopia electrónica) anfíbios, onde, por razões de estrita economia de água, se opera correntemente concentração da urina, por reabsorção da água pelo organismo, através das membranas plasmáticas das células epiteliais da bexiga.
Este fenómeno pode ser incrementado através da administração de uma hormona antidiurética. Com o auxílio de técnicas de microscopia electrónica, é possível pôr em evidência a formação de agregados partículas intrínsecas (proteínas), após a administração da hormona. Supõe-se que a esses agregados correspondem sítios de trânsito preferencial da água.
b) Gases
A exigência de que a permuta de gases como o oxigénio e o dióxido de carbono, se opere com grande rapidez e o facto de as velocidades de difusão do dióxido de carbono e do oxigénio serem praticamente idênticas, apesar de serem significativas as diferenças dos respectivos diâmetros (CO2: 450 pm; O2: 358 pm), sugerem que o esquema de transporte deste gases envolve também a existência de canais como os referidos para a água.
c) Transporte de outras moléculas (não electrólitos)
Não sendo a membrana plasmática, no plano real, uma membrana semi-permeável ideal, outras moléculas, para além das do solvente (água), difundem através dela. O fluxo de difusão é função da diferença de concentrações entre os dois lados da membrana. Consideremos o caso de duas soluções, A e B, de concentrações diferentes, separadas por uma membrana. Num dado instante, a probabilidade de que uma molécula da solução A possa chocar com a membrana sendo portadora de energia cinética suficiente para a transpor, é idêntica a probabilidade que assiste às moléculas da solução B, em sentido inverso.
Difusão, em função dos gradientes de concentração: conceito de equilíbrio dinâmico.
Todavia, se a concentração de A for superior à concentração de B, o número de moléculas que transita de A para B será superior ao número das moléculas que efectuam a difusão em sentido inverso. Dito de outro modo, as intensidades dos fluxos são diferentes, mas tendem a igualar-se quando as concentrações de ambos os lados da membrana também o forem. Quando tal se verifica, atinge-se o equilíbrio; equilíbrio dinâmico, e não estático, pois as moléculas continuam a atravessar a membrana.
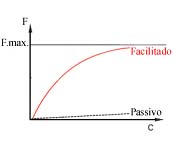
Em termos cinéticos, a velocidade com que se opera a difusão é proporcional à diferença de concentrações. Se, por hipótese, não se verificasse uma acumulação das moléculas entradas, mantendo a concentração interna constante, então o fenómeno comportar-se-ia de acordo com o gráfico da figura seguinte.
Variação do fluxo de transporte passivo em função da concentração
d) Transporte de electrólitos
Vimos atrás que, para uma substância não electolítica, a condição de equilíbrio, isto é, em que o fluxo global é nulo, é aquela em que há igualdade das concentrações ou, melhor dizendo, dos potenciais químicos da mesma substância dos dois lados da membrana.
No caso dos electrólitos, intervém um factor suplementar e a condição análoga é a ausência de diferença de potenciais electroquímicos (µ1 e µ2). Este define-se relativamente a um potencial padrão m0 de acordo com a equação:
µ = µ0 + RT ln C + z EF
onde: z é a carga do ião considerado; F, a constante de Faraday; E, o potencial eléctrico; R e T, respectivamente, a constante dos gases perfeitos e a temperatura absoluta.
No equilíbrio, os potenciais electroquímicos dos dois lados da membrana (1 e 2) atingem a igualdade:
µ1 = µ2 . Então:
RT ln C1 + z E1F = RT ln C2 + z E2F
de onde se extrai a expressão do potencial de membrana no equilíbrio Em :
Em = E1 - E2 = RT/ zF . ln C2/C1 (fórmula de Nerst)
Assim, compreende-se que as condições de equilíbrio estabelecidas para um electrólito podem compreender uma desigualdade de concentrações, desde que seja contrabalançada por uma diferença de potencial eléctrico entre os dois compartimentos
Nos casos em que z=1 e admitindo-se uma temperatura de 20 ºC, então:
Em voltes = 0,058 log C2/C1
Canais iónicos. A: canais simples; B: canais “activador dependentes”, podendo assumir a configuração alostérica aberta (A) ou fechada (F) consoante se encontrem associados ou não ao “activador” (Ac)
Ainda que a barreira fosfolipídica seja praticamente impermeável aos iões, estes atravessam a membrana graças a canais iónicos. Estes são constituídos por proteínas intrínsecas, que estabelecem entre si uma passagem, a qual poderá ser franqueada por diversos iões, com graus de especificidade variáveis.
Alguns desses canais, tirando partido das propriedades alostéricas das proteínas, podem assumir configurações alternativas de “aberto” ou “fechado”. Essas alternativas alostéricas são determinadas por factores externos, como a ligação de uma das proteínas constitutivas do canal a uma outra molécula ou a existência de um determinado potencial de membrana.
Transportes facilitados
Para as circunstâncias em que a permeabilidade de uma determinada molécula essencial à vida da célula, não permite a sua captação com a destreza requerida pelo metabolismo, a célula dispõe de mecanismos membranares específicos. Se tais mecanismos não despenderem energia, designam-se por transportes facilitados e enquadram-se, portanto, na classe dos transportes passivos. São objecto de transporte facilitado, entre outras moléculas, os monossacáridos, como a glucose, e os aminoácidos. Mas também, em certas circunstâncias, os iões são beneficiários destes sistemas de transporte
a) Não electrólitos
O exemplo clássico que ilustra as características deste tipo de transporte, é precisamente o da glucose. Reconhecendo as características que lhe estão associadas, concebe-se um modelo baseado na existência de proteínas membranares transportadoras, susceptíveis de assumirem duas configurações tridimensionais.
Modelo de transporte facilitado da glucose
O transportador de membrana pode assumir duas configurações alostéricas consoante se encontre ligado ou não a uma molécula de glucose. O sentido global do transporte obedece ao gradiente de concentrações. Tal sistema não oferece qualquer preferência de sentido, podendo promover tanto a saída como a entrada de moléculas de glucose. O sentido do fluxo é apenas determinado pelo gradiente de concentração, tal como da difusão simples. Com a diferença, porém, de que permite o trânsito de moléculas que, de outra forma, não transporiam a barreira membranar.
Estes sistemas de transporte membranar facilitado são caracterizados por (i) serem altamente específicos e (ii) saturáveis.
A alta especificidade pode ser posta em evidência, recorrendo aos isómeros ópticos da glucose: D-glucose e L-glucose. De facto, os transportadores da glucose, apenas reconhecem a D-glucose; a L-glucose, que todavia se distingue apenas pela posição de um grupo oxidrilo, não beneficia do transporte facilitado. Aplica-se ao transporte facilitado, o conhecido princípio de Fisher formulado para ilustrar a especificidade dos enzimas relativamente aos respectivos substratos : o substrato está para o enzima, como a chave, para a fechadura.
Florizina
Tal como as fechaduras se podem encravar com falsas chaves, também o mesmo pode suceder aos transportadores. Refira-se a título de exemplo que, administrando florizina a um animal, se obtém o bloqueamento dos transportadores de glucose, induzindo-se, deste modo, um aumento do teor de glucose no sangue. Tal fenómeno fica a dever-se ao facto de a molécula de florizina comportar uma D-glucose. O sistema activado reconhece e aceita a D-glucose, mas é de seguida encravado pela restante parte da molécula.
Fluxos de transporte da glucose em função da glucose: transporte facititado e passivo
Por sua vez, a saturabilidade do sistema resulta do facto de o número de transportadores de membrana de que uma célula dispõe, ser limitado. Por conseguinte, a partir do momento em que todos os transportadores de membrana tiverem entrado em acção, atinge-se a velocidade máxima de transporte, independentemente do grandeza do gradiente de concentração em causa.
b) electrólitos
Certas substâncias podem tornar as membranas permeáveis aos iões. São geralmente produzidas por microorganismos e actuam como antibióticos já que têm como efeito, contrariar drasticamente os equilíbrios iónicos funcionais das células. Intervêm enquanto tal na competição entre microorganismos, mas as suas potencialidades antibióticas são igualmente exploradas pela medicina. Designam-se pelo termo genérico de ionóforos e podem apresentar estruturas muito diversas. Apresentam em comum a característica de serem pequenas edificações moleculares hidrófobas, que se dissolvem facilmente na bicamada lipídica da membrana plasmática.
Distinguem-se essencialmente duas categorias de ionóforos: (i) aqueles que determinam a formação transitória de um canal e (ii) os que, sendo móveis, se comportam como barquetas, assegurando o transporte os iões entre as duas faces da membrana. Enquanto que o fluxo iónico proporcionado pelos
|
primeiros não é afectado por um abaixamento da temperatura, o fluxo assegurado pelos ionóforos móveis, diminui em idênticas circunstâncias. Compreende-se que assim seja, dado que a “agilidade” das barquetas depende da fluidez da membrana e esta característica é função da temperatura. Em ambos os casos, o transporte respeita o gradiente electroquímico que, como se sabe, em condições naturais, é bastante assentuado, e garantido pelas bombas de transporte activo de iões.
A valinomicina é um exemplo de ionóforo móvel. Com uma forma de anel, a valinomicina manifesta uma preferência pelo ião K+ ,10.000 superior à que oferece ao ião Na+. O anel é bordejado exteriormente por grupos hidrófobos que contactam com as cadeias alifáticas dos fosfolípidos. No interior, seis átomos de oxigénio constituem o sítio de fixação do K+.
As gramicidina (A,B e C) são exemplos de ionóforos de tipo canal. São formadas por péptidos lineares constituídos por apenas 15 aminoácidos. São necessárias duas moléculas de gramicidina para formar um canal, mas a associação é instável, pelo que os canais são transitórios, formando-se e desmanchando-se, instantaneamente. Em média, um canal permanece funcional durante um segundo. Neste lapso de tempo, a gramicidina A pode transportar 2x107 catiões monovalentes.
Transporte activo
Em alternativa aos diferentes tipos de transporte que se referiram e que têm entre si a característica comum de promoverem o tráfego molecular “a favor” dos gradientes, quer de concentrações, quer electroquímicos, sem consumo energético, outros há que actuam “contra” os gradientes. Poder-se-ia dizer, em linguagem comum, que “remam contra a maré”. Consequentemente, consomem energia; designam-se por transportes activos.
a) electrólitos
Os transportes activos melhor conhecidos são os dos iões, cujos sistemas membranares são designados habitualmente por bombas iónicas. Existem bombas para transportarem protões, catiões de cálcio, catiões de sódio e de potássio, etc. A título ilustrativo, iremos referir a bomba de sódio/potássio, por ventura a mais abundante e de existência obrigatória em todas (ou quase) as células.
A necessidade da existência de bombas iónicas decorre do facto de, por exigências funcionais, deverem manter-se elevados desníveis dos teores relativos a diferentes iões, entre o interior da célula e o exterior. No quadro seguinte revelam-se alguns valores típicos das células de mamíferos.
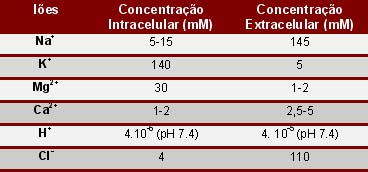
No caso específico do sódio e do potássio, seria expectável, tendo presentes os valores indicados no quadro anterior, que, a não existirem mecanismos de bombeamento de iões que contrariem o gradiente, rapidamente se atingiria o equilíbrio, graças à simples difusão dos iões através dos respectivos canais. É aliás o que, experimentalmente, se consegue, quer baixando a temperatura além do limiar de funcionamento dos enzimas, quer impedindo o fornecimento de energia às bombas. Graças porém às bombas de sódio/potássio, os fluxos passivos de saída do potássio e de entrada do sódio, são constantemente contrariados por fluxos activos. Assim se mantêm os desníveis de teor destes dois iões.
Bomba de sódio/potássio: esquema de funcionamento
Ainda que se desconheça a mecânica íntima destas bombas, demonstra-se experimentalmente que os transportes antagónicos de sódio e de potássio são (i) interdependentes e (ii) consumidores de energia, sob a forma de ATP, de tal modo que, por cada molécula de ATP hidrolizada, são bombeados 3Na+ para fora da célula e 2K+ para o seu citossol.
b) Não electrólitos
Os não electrólitos podem ser activamente transportados graças à energia potencial subjacente a gradientes iónicos, em lugar do dispêndio directo de ATP. Nestes casos o transporte de uma molécula é associado ao transporte de um ião, quer no mesmo sentido (symport) ou em sentidos contrários (antiport). Nas células animais, o ião co-transportador é geralmente o Na+. Por exemplo, o transporte activo de alguns açúcares e aminoácidos nas células animais é usualmente potenciado pelo gradiente do ião Na+ .
Captação da glucose pelas células do epitélio intestinal
Exemplo concreto é o transporte activo da glucose que ocorre na fase de assimilação pós-digestiva, ao nível do intestino. Na membrana apical das células absorventes do intestino, localizam-se mecanismos de co-transporte facilitado do Na+ e da glucose. Esses mecanismos são constituídos por unidades proteicas intrínsecas, dotadas de propriedades alostéricas e detentoras de sítios de fixação específicos para a D-glucose e para o ião Na+. O sítio de fixação da glucose só estará receptivo após a fixação do Na+. Uma vez ambos “instalados”, a proteína altera a sua conformação espacial, por forma a expor o Na+ e a glucose ao citossol.
A labilidade das ligações em causa e o contexto de agitação molecular, fazem com que tanto o ião como o açúcar se libertem no citossol. A face oposta da célula, limitada pela membrana basal, contacta com a rede de capilares sanguíneos, através dos quais os nutrientes assimilados são veiculados para o organismo. A esse nível, a glucose é transportada para fora da célula por transporte facilitado e as bombas de sódio/potássio eliminam, da célula, o excedente de Na+ . Ainda que na etapa propriamente dita de captação da glucose, não se tenha verificado consumo directo de ATP, o certo é que, globalmente, o processo é consumidor de energia, pois implica, de forma diferida é certo, o funcionamento das bombas de sódio/potássio.
Mecanismo membranar do co-transporte da glucose e do sódio.
A: transportador acessível ao meio externo com sítios de fixação do sódio, activos, e sítios de fixação da glucose, inactivos; B: a fixação do sódio induz a alteração alostérica que permite fixação da glucose; C: transportador sofre alteração alostérica, expõe-se ao citossol e liberta a glucose e o sódio; D: retorno à situação inicial.
Transportes em massa
Os sistemas que se descreveram anteriormente, destinam-se todos ao transporte de moléculas ou iões de porte relativamente pequeno. Quando porém se trata de captar uma macromolécula, tal como uma proteína, ou mesmo uma partícula maior, que pode mesmo ser uma bactéria, os mecanismos descritos já não são adequados. Nestes casos, a célula recorre ao mecanismo da endocitose, que consiste basicamente na formação de uma depressão membranar, seguida do envolvimento de uma porção do meio extracelular onde a(s) partícula(s) se encontra(m), da invaginação da membrana e, finalmente, a formação de numa vesícula, denominada genericamente por endossoma.
a) Fagocitose e pinocitose
Na sua expressão mais simples, a endocitose é um mecanismo pouco ou nada específico do objecto a captar. Distinguem-se habitualmente duas modalidades em função da escala: a fagocitose (do grego phagein: comer) e a pinocitose (do grego pinein: beber). A primeira, se o destinatário é uma partícula de grande porte, uma bactéria por exemplo, de tal modo que o fenómeno seja observável em microscopia fotónica; a segunda, se os objectos a captar são macromoléculas e, consequentemente, o fenómeno não será observável em microscopia fotónica.
Endocitoses. A: pinocitose; B: fagocitose
A ausência de especificidade destes mecanismos é posta em evidência através de experiências simples que consistem em fornecer a protozoários “de laboratório” como amibas ou paramécias, suspensões de elementos nutritivamente neutros tal como microsferas de latex ou partículas de carbono (tinta da China). Observa-se que os animais capturam indiferentemente essas partículas como outras com valor nutritivo.
A observação do fenómeno, em microscopia electrónica, com recurso a partículas neutras (marcadores), como as microsferas de latex, ouro coloidal ou ferritina, uma proteína rica em ferro, permite distinguir a existência de duas fases do fenómeno: uma fase de aderência das partículas ao cell coat da membrana, seguida da fase de ingestão.
b) Endocitose por receptores
Contrariamente às endocitoses correntes que não aparentam qualquer grau de especificidade, outras há que são altamente específicas, devido à presença, em certas zonas da superfície membranar, de receptores. Estes são constituídos por proteínas intrínsecas e possuem sítios de fixação específicos de determinada substância. Graças às suas propriedades alostéricas, estas proteínas são susceptíveis de assumir configurações tridimensionais alternativas. Quando ligadas ao substrato, as alterações estruturais que as proteínas receptoras sofrem, manifestam-se do lado oposto da membrana, onde interactuam com uma malha proteica que reveste a membrana. Este revestimento é observado em microscopia electrónica e aparentemente encontra-se confinado a determinadas zonas deprimidas da membrana, razão pela qual estas se designam por coated pits. Esta malha de revestimento relaciona-se, segundo se supõe, com as deformações da membrana inerentes ao processo de endocitose e à formação dos endossomas; é formada por uma proteína fibrosa designada por clatrina, cuja molécula é caracterizada por possuir três braços através dos quais se associam umas às outras e que se designa por trisquélion.
Estrutura da clatrina e formação da malha de revestimento dos coated pits e das coted vesicles .
Supõe-se que os receptores se relacionam com a malha de clatrina por intermédio de outras proteínas designadas por adaptinas. Após a endocitose, formam-se endossomas que mantém o mesmo aspecto de revestimento, pelo que se designam por coated vesicles
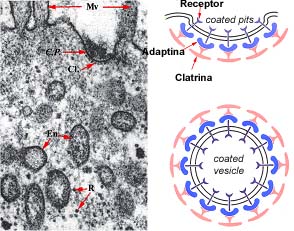
Endocitose por receptores: estrutura e formação dos endossomas
Cl : clatrina; C.P : Coated pits ; En: endossomas; Mv: microvilosidades; R: ribossomas
As moléculas de colesterol, quando em circulação no organismo, entre outras, beneficiam destes mecanismos de captação por parte das células. Com efeito, o colesterol, dada a sua hidrofobia, não pode circular livremente no sangue. Habitualmente, as moléculas deste lípido pesado, após serem esterificadas por ácidos gordos, associam-se em aglomerados aproximadamente esféricos e recobertos externamente por uma camada de fosfolípidos. Estes dispõem-se de forma a expor as “cabeças” hidrófilas ao meio e a virar as “caudas” hidrófobas, para o interior, isto é, para a massa de colesterol. Em associação com o recobrimento de fosfolípidos, encontra-se uma proteína. Em função da proporção entre lípidos e proteínas, assim estes corpúsculos serão mais ou menos densos, distinguindo-se quatro categorias, em ordem crescente de densidades
: os quilomicra, os VLDL (Very Light Density Lipoprotein), os LDL e os HDL. Os LDL (Light Density Lipoprotein) são provavelmente os melhor conhecidos do ponto de vista estrutural e dos mecanismos de endocitose disponibilizados pelas células para os captarem.
Os receptores dos LDL reconhecem especificamente as lipoproteínas periféricas e é através delas, consequentemente, desencadeia-se o processo de endocitose .
Estrutura de um LDL. Col.: colesterol; P.l : proteína ligante
RETORNO >