

ÁGUA
Na molécula da água, o oxigénio estabelece duas ligações covalentes com dois átomos de hidrogénio e o equilíbrio de forças entre as diferentes orbitais de electrões, determina uma disposição geometricamente assimétrica das ligações O-H, que formam entre si um ângulo de cerca de 104º
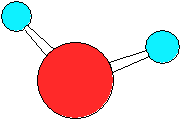
Estrutura da molécula de água
Por sua vez, a forte electronegatividade que caracteriza o núcleo do átomo de oxigénio provoca a deslocação dos electrões em direcção a este, deixando os hidrogénios desguarnecidos dos seus próprios electrões. Desta feita, acentua-se a assimetria da molécula de água que, apesar de ser globalmente neutra, apresenta uma distribuição irregular das cargas eléctricas, que lhe confere uma polaridade. Nesta circunstâncias, os átomos de hidrogénio assemelham-se, em certa medida, a simples protões. A água é, por conseguinte, uma substância polar, e a molécula comporta-se como um dipolo.
As ligações hidrogénio ou pontes de hidrogénio, inter- ou intra-moleculares, são características de compostos hidrogenados que contêm átomos de flúor, oxigénio, enxofre ou azoto. Resultam da atracção mútua entre um átomo de hidrogénio com carga residual positiva e um átomo electronegativo, com carga residual negativa (que pode ser um dos quatro acima referidos). As energias de ligação variam entre 3 e 7 Kcal/mole, em função da electronegatividade dos átomos envolvidos. São portanto ligações fracas, comparativamente com as ligações covalentes que encerram energias da ordem 50 a 100 Kcal/mole.
Por tudo quanto se viu atrás, os dipolos de água possuem as propriedades necessárias para estabelecerem entre si, pontes de hidrogénio.
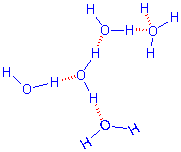
Moléculas de água ligadas por pontes de hidrogénio
Assim, a água no estado líquido, apresenta-se como um complexo semi-cristalino de moléculas, sendo o número de pontes de hidrogénio função inversa da temperatura. No estado sólido, as moléculas estabelecem entre si o número máximo de pontes, 4, e dispõem-se segundo uma malha hexagonal (fig.3.2). Esta obriga a um maior distanciamento entre as moléculas, do que aquele que se verifica no estado líquido. Em consequência, a água aumenta de volume quando gela.
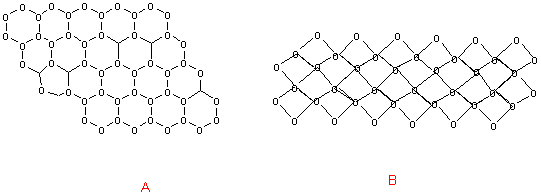
Malha de moléculas de água congelada (A) e líquida (B)
Por força da coesão molecular que as pontes de hidrogénio determinam, a passagem da água do estado líquido ao estado de vapor é mais exigente do ponto de vista energético do que se verifica em outros hidretos (H2S, H2Te, H2Se). O ponto de ebulição é, consequentemente, mais elevado.
A dissolução de um composto (soluto) num solvente ocorre desde que o conjunto das atracções entre as moléculas do composto e do meio sejam pelo menos equivalentes ou superiores às que existiam entre as moléculas do soluto, por um lado, e as do solvente, por outro. A capacidade da água de dissolver um maior número de substâncias do que qualquer outro líquido comum, decorre das suas propriedades polares e, consequentemente, do estabelecimento de pontes de hidrogénio com as moléculas dessas substâncias.
Nem todas as moléculas orgânicas são solúveis na água. Apenas as moléculas polares, ou hidrofílicas, o são. Quando tal acontece, as moléculas do soluto são separadas e envolvidas por um “manto” molecular de água. Por oposição, designam-se hidrofóbicas, as que se não dissolvem na água.
No caso dos iões, originam-se forças atractivas entre as suas cargas eléctricas e os pólos de sinal contrário das moléculas de água. Por conseguinte, também os iões se vêem envolvidos por uma camada molecular de água, que aumenta em muito o seu raio iónico.
Quadro
Raios iónicos dos iões Na+, K+ e Cl- , expressos em picómetros (1 pm= 10-12 m)
Ião |
Raio iónico (pm) |
|
Forma não-hidratada |
Forma hidratada |
|
Na+ |
97 |
370 |
K+ |
133 |
405 |
Cl- |
181 |
390 |